तत्वों का आवर्ती वर्गीकरण ( लघु उत्तरीय प्रश्न ) Tatvon ka vargikaran question answer class 10th science tatvon ka vargikaran question answer Bihar board
तत्वों का आवर्त वर्गीकरण प्रश्न उत्तर : class 10th science तत्वों का आवर्त वर्गीकरण का प्रश्न उत्तर यहाँ पर दिया गया है। जो परीक्षा के लिए बहुत महतवपूर्ण है। class 10th science question answer in hindi. तत्वों का वर्गीकरण ऑब्जेक्टिव प्रश्न उत्तर क्लास 10th विज्ञान तत्वों का आवर्ती वर्गीकरण लघु उत्तरीय प्रश्न तथा दीर्घ उत्तरीय प्रश्न यहां पर दिया गया है class 10th science subjective question
1. न्यूलैंड के अष्टक सिद्धांत की क्या सीमाएँ हैं ?
उत्तर⇒ न्यूलैंड के अष्टक सिद्धांत की सीमाएँ हैं.
(i) अष्टक का सिद्धांत केवल कैल्सियम तक ही लागू होता था, क्योंकि कैल्सियम के बाद प्रत्येक आठवें तत्त्व का गुणधर्म पहले तत्त्व से नहीं मिलता।
(ii) बाद में कई नये तत्त्व पाए गये जिनके गुणधर्म अष्टक सिद्धांत से मेल नहीं खाते थे।
(ii) अपनी सारणी में इन तत्त्वों को समंजित करने के लिए न्यूलैंड ने दो तत्त्वों को एक साथ रख दिया और कुछ असमान तत्त्वों को एक स्थान में रख दिया।
उदाहरण- कोबाल्ट तथा निकेल एक साथ हैं तथा इन्हें एक साथ उसी स्तम्भ में रखा गया है जिसमें फ्लुओरीन, क्लोरीन एवं ब्रोमीन हैं यद्यपि इनके गुणधर्म उन दोनों तत्त्वों से भिन्न हैं। आयरन को कोबाल्ट एवं निकेल से दूर रखा गया है जबकि उनके गुणधर्मों में समानता होती है।
2. तत्त्वों के आवर्त वर्गीकरण के लिए परमाणु द्रव्यमान संख्या की अपेक्षा परमाणु संख्या को उत्तम आधार क्यों माना गया है ?
उत्तर⇒ तत्त्व का परमाणु द्रव्यमान नाभिक के कारण है। नाभिक तत्त्व के केन्द्र में स्थित है। इसमें प्रोटॉन और न्यूट्रॉन हैं, जिनका पुंज होता है। तत्त्व का नाभिक गुणों की व्याख्या नहीं करता। वास्तव में तत्त्वों के गुण इलेक्ट्रॉनिक वितरण से संबंधित हैं। ज्यों-ज्यों परमाणु संख्या बदलती है वैसे-वैसे इलेक्ट्रॉनिक वितरण भी बदलता जाता है। इसलिए परमाणु तत्त्वों के वर्गीकरण का उत्तम आधार है।
| Also Read : class 10th science objective |
3. नाइट्रोजन (परमाणु संख्या 7) तथा फॉस्फोरस (परमाणु संख्या 15) आवर्त सारणी के समूह 15 के तत्त्व है। इन दोनों तत्त्वों का इलेक्ट्रॉनिक विन्यास लिखिए। इनमें से कौन-सा तत्त्व अधिक ऋण विद्युत होगा और क्यों ?
उत्तर⇒ N (Z = 7) 2,5
P (Z = 15) 2,8,5
N अधिक वैद्युत ऋणात्मक होगा, क्योंकि इसका परमाण्वीय आकार अपेक्षाकृत कम होता है। किसी वर्ग में जब शीर्ष से तल (आधार) की ओर बढ़ते हैं, प्रत्येक स्तर पर परमाणुओं में इलेक्ट्रॉनों का एक कोश बढ़ता जाता है। इस प्रकार परमाणुओं में इलेक्ट्रॉन कोशों की संख्या धीरे-धीरे बढ़ती जाती है जिसके कारण परमाणुओं का आकार भी बढ़ता है। परमाणु के आकार में इस वृद्धि के कारण, उसका नाभिक परमाणु में और अन्दर चला जाता है। आने वाले इलेक्ट्रॉन के लिए नाभिक K का आकर्षण कम हो जाता है, जिसके कारण परमाणु आसानी से ऋणायान नहीं बना सकता है और ऋण विद्युत लक्षण कम होता जाता है।
4. तत्वों का वर्गीकरण किस प्रकार किया गया है ? आवर्त सारणी में वर्ग तथा आवर्त क्या हैं ?
उत्तर⇒ तत्वों के गुण उनके परमाणु क्रमाकों के आवर्त फलन होते हैं। जब तत्वों को उनके बढ़ते परमाणु संख्या के आधार पर रखा जाए तो समान गुणों वाले तत्व नियमित अंतर के बाद प्रकट होते हैं । इलेक्ट्रॉन विन्यास इसका मूल आधार है।
वर्ग : आवर्त सारणी में उर्ध्वाधर (खड़े) कालम समूह वर्ग कहलाते हैं।
आवर्त : आवर्त सारणी में क्षैतिज कॉलम आवर्त कहलाते हैं।
5. धनायन का आकार परमाणु से कम क्यों होता है ? व्याख्या कीजिए।
उत्तर⇒ धनायन को धन आयन भी कहते हैं। यह परमाणु द्वारा एक या एक से अधिक इलेक्ट्रॉन खो देने पर बनता है । इलेक्ट्रॉन खोने पर प्रायः शैलों की संख्या कम हो जाती है। इसलिए धनायन का आकार परमाणु के आकार से कम होता है।
6. न्यूलैंड्स के अष्टक नियम को लिखें।
उत्तर⇒ 1866 ई० में अंग्रेज वैज्ञानिक जॉन न्यलैंडस ने सात तत्त्वों को परमाणु द्रव्यमान के आरोही क्रम में व्यवस्थित किया। उन्होंने सबसे कम परमाणु द्रव्यमान वाले तत्त्व वाल तत्त्व हाइड्रोजन से आरंभ किया तथा 56वें तत्त्व थोरियम पर इसे समाप्त किया। उन्होंने पाया कि प्रत्येक आठवें तत्त्व का गणधर्म पहले तत्त्व के गुणधर्म के समान है। उन्होंने इसकी तुलना संगीत के अष्टक से की और इसलिए इन्होंने अष्टक का सिद्धांत कहा। इसे “न्यूलैंड्स का अष्टक सिद्धांत” कहा जाता है।
7. तत्त्वों के वर्गीकरण में डॉबेराइनर के क्या आधार थे ?
उत्तर⇒ डॉबेराइनर ने समान गुणधर्मों वाले तत्त्वों को समूहों में व्यवस्थित करने का प्रयास किया। उन्होंने तीन-तीन तत्त्व वाले कुछ समूहों को चुना एवं उन समूहों को त्रिक कहा। डॉबेराइनर ने बताया कि त्रिक के तीनों तत्त्वों का उनके परमाणु द्रव्यमान, के आरोही क्रम में रखने पर बीच वाले तत्त्व का परमाणु द्रवयमान अन्य दो तत्त्वों के परमाणु द्रव्यमान का लगभग औसत होता है।
8. आवर्त में बायीं से दायीं ओर जाने पर इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति कैसे परिवर्तित होगी ?
उत्तर⇒ आवर्त में बायीं से दायीं ओर बढ़ने पर बाहरी कोश में इलेक्ट्रॉनों की संख्या क्रमानुसार बढ़ती जाती है। अतः अष्टक की प्राप्ति में एकांतर रूप से कम इलेक्ट्रॉनों की आवश्यकता होगी। अतः इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति बढ़ती है।
9. तत्त्वों के इलेक्ट्रॉनिक विन्यास का आधुनिक आवर्त सारणी में तत्त्व की स्थिति से क्या संबंध है ?
उत्तर⇒ आधुनिक आवर्त सारणी तत्त्वों के परमाणु संख्या के आरोही क्रम में सजाया गया है। अगर एक तत्त्व Mg (परमाणु संख्या 12) है तो आवर्त सारणी में ऐलुमिनियम परमाणु संख्या 13 को एक ही आवर्त में रखा गया है। जबकि Mg समूह 2 में और ऐलुमिनियम समूह 13 में। Mg का इलेक्ट्रॉनिक विन्यास (2,8,2) है और Al का इलेक्ट्रॉनिक विन्यास (2,8,3) है। आवर्त में लगातार बायीं से दायीं ओर जाने पर संयोजकता इलेक्ट्रॉन में क्रमानुसार 1 इलेक्ट्रॉन की वृद्धि होती है। इसी प्रकार एक समूह (2) में Mg (12) और कैल्सियम परमाणु संख्या (20) लिया जाए तो इनका इलेक्ट्रॉनिक विन्यास (2,8,2) और (2,8,8,2) प्राप्त होता है। इन्हें एक समूह में रखा गया है, लेकिन Mg में तीन कोश और Cu में चार कोश प्राप्त है। दोनों तत्त्वों की संयोजकता समान (2) है। लेकिन Mg का परमाणु साइज Ca के परमाणु साइज से छोटा है। अतः इलेक्ट्रॉनिक विन्यास के आधार पर उनके परमाणु संख्या को ध्यान में रखकर तत्त्वों को आवर्त सारणी में स्थान दिया गया है। अतः तत्त्वों के इलेक्ट्रॉनिक विन्यास का आधुनिक आवर्त सारणी तत्त्वों की स्थिति से संबद्ध है। किसी भी तत्त्व को आवर्त सारणी में देखकर उसके बारे में अधिक से अधिक जानकारी प्राप्त की जा सकती है।
10. मेंडलीव के आवर्त सारणी की विसंगतियों को लिखें।
उत्तर⇒ मेंडलीव के आवर्त सारणी की विसंगतियाँ निम्न हैं –
(i) निश्चित रूप से आवर्त सारणी में हाइड्रोजन का नियत स्थान नहीं दिया जा सका है। यह मेंडलीव के आवर्त सारणी की पहली कमी थी। उन्होंने अपनी सारणी में हाइड्रोजन को उचित स्थान नहीं दे सके।
(ii) मेंडलीव आवर्त सारणी में समस्थानिकों और नोबल गैसों के लिए कोई स्थान नहीं दिया गया।
(iii) मेंडलीव आवर्त सारणी में एक तत्त्व से दूसरी तत्त्व की ओर बढ़ने पर परमाणु द्रव्यमान नियमित रूप से नहीं बढ़ते। इसलिए यह अनुमान लगाना होगा कि दो तत्त्वों के बीच कितने तत्त्व खोजे जा सकते हैं। जब भारी तत्त्वों पर विचार करते हैं तो कठिनाई उत्पन्न हो जाती है।
11. मेंडलीफ ने तत्त्वों का वर्गीकरण किस आधार पर किया ?
उत्तर⇒ मेंडलीफ ने अपनी सारणी में तत्त्वों को उनके मूल गुणधर्म, परमाणु द्रव्यमान तथा रासायनिक गुणधर्मों में समानता के आधार पर व्यवस्थित किया।
12. डॉबेराइनर के तत्त्वों के वर्गीकरण की क्या सीमाएँ थीं ?
उत्तर⇒
(i) उस समय तक ज्ञात सभी तत्त्वों का वर्गीकरण त्रिक के आधार पर नहीं हो सका।
(ii) यह त्रिक नियम कुछ ही तत्त्वों तक सीमित रहा।
(iii) उस समय तक ज्ञात तत्त्वों में केवल तीन त्रिक ही ज्ञात हो सके।
13. आवर्त में बायीं से दायीं ओर जाने पर परमाणु त्रिज्या क्यों घटती है ?
उत्तर⇒ नाभिक में आवेश के बढ़ने से यह इलेक्ट्रॉनों को नाभिक की ओर खींचता है जिससे परमाणु का आकार घटता है और इसकी परमाणु त्रिज्या घट जाती है।
14. उत्कृष्ट गैसों को अलग समूह में क्यों रखा गया है ?
उत्तर⇒ उत्कृष्ट गैसें He, Ar, Ne आदि के परमाणु क्रमांक क्रमश: 2, 18, 10 हैं। इनका इलेक्ट्रॉनिक विन्यास (2), (2, 8, 8), (2,8) है। इनकी संयोजकताएँ शून्य हैं अतः इन्हें अलग समूहों में रखा गया क्योंकि इनके इलेक्ट्रॉनिक विन्यास भिन्न-भिन्न हैं।
15. आपके अनुसार उत्कृष्ट गैसों को अलग समूहों में क्यों रखा गया ?
उत्तर⇒ चूँकि ये गैसें मेंडलीफ आवर्त सारणी के बनने के काफी बाद पाया गया, जिसे सारणी में खाली जगहों में रखा गया। सभी गैसें अभिक्रियाशील थे, अतः उन्हें एक अलग समूह में रखना उचित था।
16. समूह में इलेक्ट्रॉन त्यागने की प्रवृत्ति किस तरह बदलती है ?
उत्तर⇒ समूह में नीचे की ओर संयोजकता इलेक्ट्रॉन पर क्रिया करने वाला प्रभावी नाभिकीय आवेश घटता है, क्योंकि सबसे बाहरी इलेक्ट्रॉन नाभिक से दूर होते हैं। इसलिए यह इलेक्ट्रॉन सुगमतापूर्वक निकल जाते हैं।
17. समह में ऊपर से नीचे जाने पर संयोजकता किस प्रकार परिवर्तित होती है ?
उत्तर⇒ समूह में ऊपर से नीचे जाने पर तत्त्वों की संयोजकताएँ स्थिर रहती हैं। समूह 1 के तत्त्वों की संयोजकताएँ 1 और समूह 2 के तत्त्वों की संयोजकताएँ 2 होती हैं। इसी प्रकार समूह 3 और 4 के परमाणुओं की संयोजकताएँ 3 और 4 होंगी।
18. समूह में ऊपर से नीचे की ओर जाने पर इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति कैसे परिवर्तित होगी ?
उत्तर⇒ समूह में ऊपर से नीचे की ओर जाने पर अधातुओं में कोशों की संख्या बढ़ती है लेकिन संयोजकता इलेक्ट्रॉन समान रहती है। अत: इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति घटती है जबकि कोशों की संख्या बढ़ती है। अधातुओं में ऋणात्मकता की प्रवृत्ति रहती है जिससे यह इलेक्ट्रॉन ग्रहण करने की प्रवत्ति रखता है। लेकिन समह में ऊपर से नीचे आने पर इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति घटती है क्योंकि आयनाकरण उर्जा की कमी होती है।
class 10th science question answer in hindi
| S.N | Physics ( भौतिक विज्ञान ) लघु उत्तरीय प्रश्न |
| 1 | प्रकाश के परावर्तन तथा अपवर्तन |
| 2 | मानव नेत्र तथा रंगबिरंगा संसार |
| 3 | विधुत धारा |
| 4 | विधुत धारा के चुंबकीय प्रभाव |
| 5 | ऊर्जा के स्रोत |
| S.N | Chemistry ( रसायन विज्ञान ) लघु उत्तरीय प्रश्न |
| 1 | रासायनिक अभिक्रियाएं एवं समीकरण |
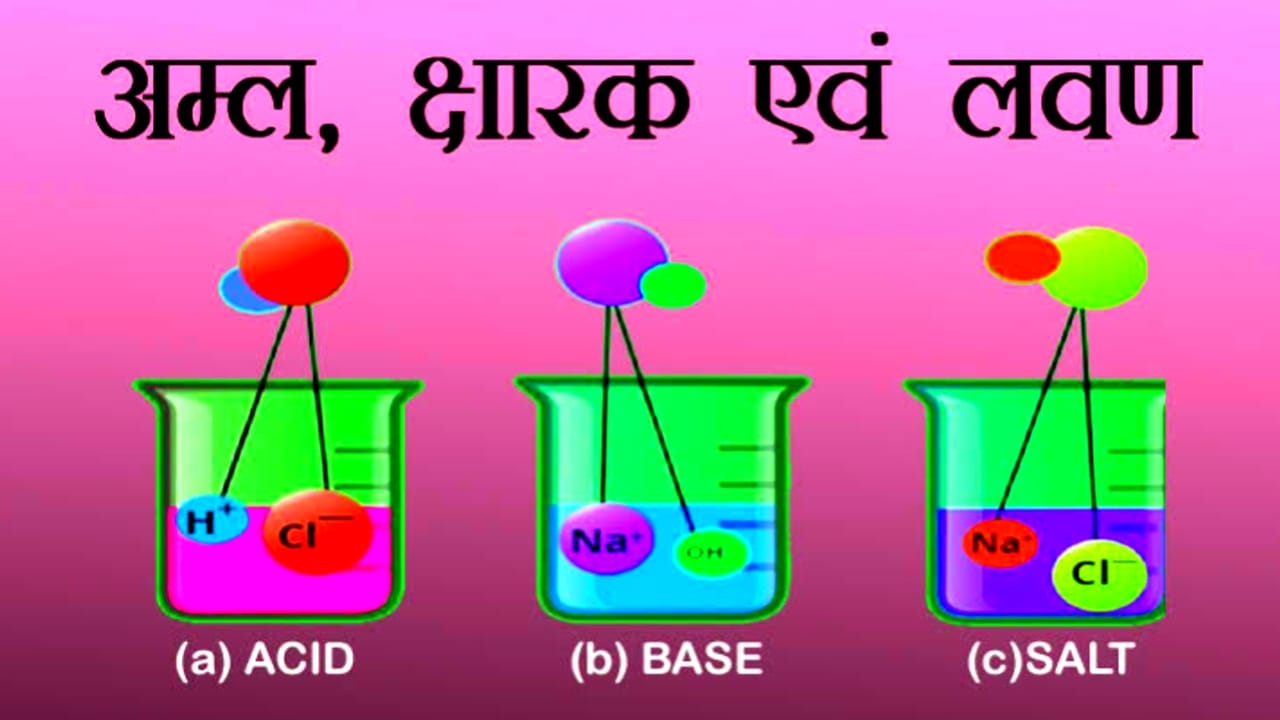
| 2 | अम्ल क्षार एवं लवण |
| 3 | धातु एवं अधातु |
| 4 | कार्बन और उसके यौगिक |
| 5 | तत्वों का वर्गीकरण |
| S.N | Biology ( जीव विज्ञान ) लघु उत्तरीय प्रश्न |
| 1 | जैव प्रक्रम |
| 2 | नियंत्रण एवं समन्वय |
| 3 | जीव जनन कैसे करते हैं |
| 4 | अनुवांशिकता एवं जैव विकास |
| 5 | हमारा पर्यावरण |
| 6 | प्राकृतिक संसाधनों का प्रबंधन |
तत्वों का आवर्त वर्गीकरण Questiion Answer
तत्वों का आवर्त वर्गीकरण क्लास 10th विज्ञान का लघु उत्तरीय प्रश्न यहां पर दिया गया है तथा इस वेबसाइट पर ऑब्जेक्टिव क्वेश्चन भी आसानी से मिल जाएगा और आप लोग डाउनलोड कर सकते हैं। tatvo ka avart vargikaran question answer 10th class science objective Questions in Hindi pdf. तत्वों का आवर्त वर्गीकरण कक्षा 10