धातु एवं अधातु ( दीर्घ उत्तरीय प्रश्न ) class 10th science objective question exam Bihar board Matric exam 2022
क्लास 10th विज्ञान धातु एवं अधातु चैप्टर का दीर्घ उत्तरीय प्रश्न यहां पर दिया गया है। जो मैट्रिक परीक्षा 2022 के लिए बहुत महत्वपूर्ण है। तथा धातु और अधातु पाठ का ऑब्जेक्टिव क्वेश्चन और धातु और अधातु सब्जेक्टिव क्वेश्चन के साथ-साथ क्लास 10th विज्ञान का ऑनलाइन टेस्ट भी यहां पर मिल जाएगा। class 10th Dhatu aur adhatu chapter objective question answer for Bihar board
1. धातुओं के रासायनिक गुणधर्मो को लिखें।
उत्तर ⇒ धातुएँ विद्युत रासायनिक धनात्मक तत्त्व होती हैं। इनको विद्युत धनात्मक तत्त्व इसलिए कहते हैं, क्योंकि ये इलेक्ट्रॉन त्याग कर आयनीकृत होती हैं तथा धनायन निर्मित करती हैं।
उदाहरणार्थ – K → K+ + e–, Ca → Ca2+ 2e–
धातुओं के विधुत धनात्मक अभिलक्षण द्वारा कुछ विशेष अभिलाक्षणिक रासायनिक गुणधर्म उत्पन्न होते हैं।
(a)धातुओं की अभिक्रिया ऑक्सीजन के साथ-धातुएँ ऑक्सीजन के साथ अभिक्रिया कर धातु के ऑक्साइड बनाती हैं।
2Mg + O2 → 2Mgo
धातु के ऑक्साइड की प्रकृति क्षारकीय होती है लेकिन एलुमीनियम, जिंक की ऑक्साइड अम्लीय और क्षारकीय दोनों होती है। इस प्रकार के धातु ऑक्साइडों को उभयधर्मी ऑक्साइड कहते हैं।
अधिकांश धातु ऑक्साइड जल में अघुलनशील हैं लेकिन कुछ धातु के ऑक्साइड तीव्रता से अभिक्रिया कर क्षार बनाते हैं।
जैसे – Na2O + H2O
K2O + H2O → 2KOH
(b) धातु की अभिक्रिया जल से-धातुएँ जल के साथ अभिक्रिया कर संगत धातु हाइड्रॉक्साइड अथवा ऑक्साइड बनाते हैं और हाइड्रोजन गैस मुक्त करती हैं।
जैसे- 2K + 2H2O → 2KOH + H2
2Na + 2H2O → 2NaOH + H2
कुछ धातुएँ जल से मंद गति से अभिक्रिया करती हैं।
जैसे — Ca + 2H2O → Ca(OH)2 +H2
मैग्नीशियम गर्म जल से अभिक्रिया कर मैगनीशियम हाइड्रोक्साइड तथा H 2 गैस मुक्त करती है।
2Mg + 2H2O → 2Mg(OH)2 + H2
Al, Zn और Fe जल के भाप से अभिक्रिया कर हाइड्रोजन गैस मुक्त करता है।
2Al + 3H 2O → Al2O3 +3H2O
3Fe + 4H2O → Fe3O4 + 4H2O
(c) धातुएँ अम्लों के साथ अभिक्रिया कर धातु के लवण और हाइड्रोजन गैस मुक्त करता है।
Mg + 2HCL → MgCl2 + H2
Zn + 2HCl → ZnCl2 +H2
धातुएँ HNO3 से अभिक्रिया करता और H2 गैस मुक्त नहीं करता है।
(d) धातुएँ क्लोरीन संग अभिक्रिया कर धातु के क्लोराइड बनाता है।
Ca + Cl2 → CaCl2
(e) धातुएँ हाइड्रोजन के साथ विशेष परिस्थितियों में अभिक्रिया कर धातु के हाइड्रॉइड बनाता है।
जैसे – 2Na + H2 → 2NaH
Ca + H2 → CaH2
| Also Read : class 10th science objective |
2. अधातुओं के रासायनिक गुणधर्मों को लिखें।
उत्तर ⇒ अधातुएँ इलेक्ट्रॉनों को ग्रहण कर ऋणायन बनाता है।
Cl + e– → Cl–
O + 2e– → O2-
S + 2e– → S2-
(a) ऑक्सीजन के साथ अभिक्रिया – अधातुएँ ऑक्सीजन से संयोग कर ऑक्साइड बनाती हैं। इनके ऑक्साइड अम्लीय अथवा उदासीन होते हैं। अधातुओं के बीच इलेक्ट्रॉनों की साझेदारी होती है और अधातु ऑक्साइड बनाते हैं। अतः इन्हें सहसंयोजी यौगिक कहते हैं।
C(s) + O 2(g) → Co2(g)
S(s) + O 2(g) → SO2(g)
Co2 और SO2 दोनों ही अम्लीय ऑक्साइड है अतः ये जल में घुलकर अम्ल बनाते हैं।
CO2 + H2O → H2CO3
कार्बनिक अम्ल
So2 + H2O → H2SO3
सल्फ्यूरसअम्ल
CO एवं N2O उदासीन ऑक्साइड के उदाहरण हैं। लिटमस पत्रों के प्रति उदासीन हैं।
(b) अम्लों के साथ अभिक्रिया – अधातुएँ तनु अम्लों से हाइड्रोजन विस्थापित नहीं करती हैं। तनु अम्लों से अधातुओं द्वारा हाइड्रोजन तभी विस्थापित हो सकती है जब अभिक्रिया द्वारा उत्पन्न प्रोटॉनों (H +) को इलेक्ट्रॉनों की पूर्ति की जाए।
H2SO4 (aq.) → 2H + (aq.) + SO42 (aq.)
2H + (aq.) + 2e – → H2(g)
अधातुएँ इलेक्ट्रॉन ग्राही होती हैं। इनके द्वारा प्रोटॉनों (H +) को इलेक्ट्रॉनों की पूर्ति नहीं हो सकती है। अतः अधातुएँ तनु अम्लों से हाइड्रोजन को विस्थापित नहीं कर सकती है।
(c) क्लोरीन के.साथ अभिक्रिया – अधातुएँ क्लोरीन के साथ अभिक्रिया करके सहसंयोजी क्लोराइड निर्मित करती है। सहसंयोजी क्लोराइड सामान्यतः वाष्पशील द्रव अथवा गैस होती है। जैसे—फॉस्फोरस क्लोराइड।
P4(s) + 6Cl2(g) → 4PCI3 (g)
फॉस्फोरस ट्राइक्लोराइड
(d) हाइड्रोजन के साथ अभिक्रिया – अधातुएँ हाइड्रोजन के साथ संयुक्त होकर हाइड्राइड प्रदान करती हैं। जैसे अमोनिया (NH3), मिथेन (CH 4), हाइड्रोजन सल्फाइड (H 2S), जल (H 2O) इत्यादि।
इनके यौगिक स्थायी होते हैं जो अधातु एवं हाइड्रोजन परमाणुओं के मध्य इलेक्ट्रॉन युग्म के सहभाजन के फलस्वरूप प्राप्त होते हैं।
N2(g) + 3H 2(g) → 2NH3(g)
H2(g) + S(s) → H2S(g)
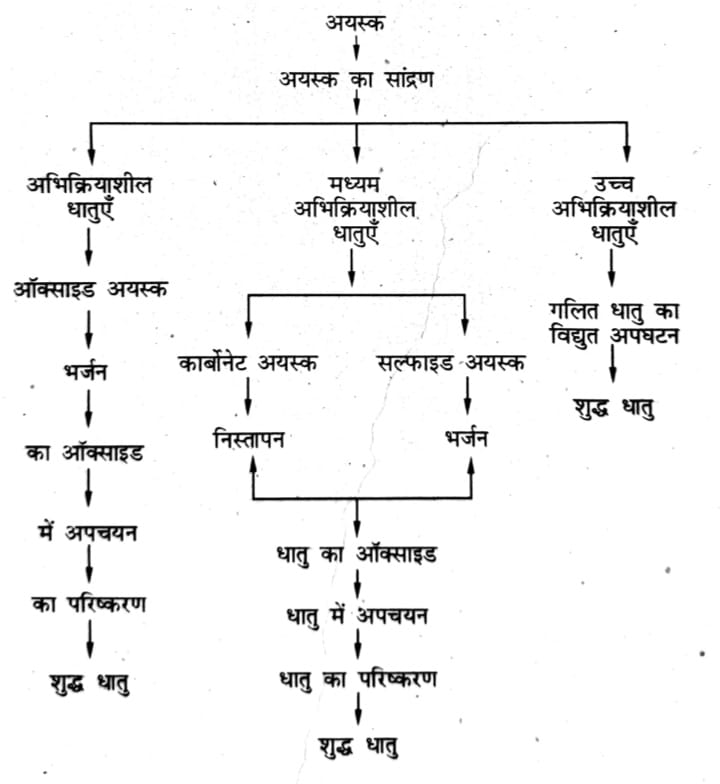
3. अयस्कों से धातु के निष्कर्षण में प्रयुक्त चरणों को लिखिए।
उत्तर ⇒ धातुकर्म — धातु के अयस्कों से शुद्ध धातु प्राप्त करना एवं उनका शुद्धिकरण आदि धातुकर्म कहा जाता है। अयस्क से शुद्ध धातु के निष्कर्षण के विभिन्न चरण इस प्रकार हैं -:
4. धातुओं के भौतिक गुणधर्मों को लिखें।
उत्तर ⇒ धातुओं के भौतिक गुणधर्म निम्नांकित हैं-:
(i) धात्विक चमक – प्रत्येक धातु का अपना धात्विक चमक होता है जिससे इसे पहचानने में सुविधा होती है। धातुओं में यह गुण धात्विक चमक है।
(ii) कठोरता – धातुएँ समान्यत: कठोर होती हैं आयरन, ऐलुमिनियम तथा कॉपर काफी कठोर धातएं हैं। इन्हें चाक से नहीं काटा जा सकता है। लेकिन Na, और पोटैशियम धातु मुलायम है जिसे चाकू से भी काटा जा सकता है। यह गुण कठोरता कहलाती है।
(iii) आघातवर्ध्यता एवं तन्यता – धातुओं को हथौड़े से पीटकर पतला चादर बनाया जा सकता है। धातु का यही गुण आघातवर्ध्यता कहलाता है।
धातुओं के तार खींचें जा सकते हैं। यह गुण तन्यता कहलाती है।
(iv) ऊष्मीय तथा विद्युतीय चालकता – धातु के एक सिरे को गर्म करने पर दूसरा सिरा भी गर्म हो जाता है। धातु में यह गुण ऊष्मीय चालकता कहलाता है। धातु के तार द्वारा विद्युत एक स्थान से दूसरे स्थान तक भेजा जा सकता है। धातुओं में यह गुण विद्युतीय चालकता कही जाती है।
5. अधातु के पाँच भौतिक गुणों को लिखिए।
उत्तर ⇒अधातुओं के गुण –
(i) अधातुओं में धात्विक चमक नहीं होती है। अपवाद आयोडीन।
(ii) अधातुएँ ऑक्साइड प्रदान करती हैं।
(iii) अधातु के गलनांक और क्वथनांक निम्न होते हैं।
(iv) अधिकतर अधातुएँ गैसीय अवस्था में पायी जाती हैं। कुछ अधातुएँ ठोस और द्रव अवस्था में भी पाई जाती हैं। जैसे ब्रोमीन द्रव अवस्था में और सल्फर ठोस अवस्था में रहती है।
(v) अधातुएँ जल में अल्प घुलनशील होती हैं।
6. आयनिक यौगिकों के गुणधर्मों को लिखें।
उत्तर ⇒आयनिक यौगिक के निम्नांकित गुणधर्म हैं –
(i) इसका गलनांक तथा क्वथनांक उच्च होता है।
(ii) इनके धन और ऋण आयनों के बीच मजबूत आकर्षण बल के कारण ये यौगिक ठोस एवं थोड़े कठोर होते हैं।
(iii) ये यौगिक सामान्यतः जल में घुलनशील होते हैं। लेकिन पेट्रोल, किरोसीन आदि जैसे विलायकों में अघुलनशील होते हैं।
(iv) इस यौगिक के जलीय विलयन विद्युत के अच्छे चालक हैं, तथा आयन विपरीत इलेक्ट्रोड की ओर गमन करते हैं।
7. निम्नलिखित पदों की व्याख्या करें :
(क) खनिज (ख) अयस्क (ग) गैंग
उत्तर ⇒ (क) खनिज – भू-पर्पटी में प्राकृतिक रूप से पाए जाने वाले तत्त्वों या यौगिकों को खनिज कहते हैं। ये प्रायः खानों से निकाले जाते हैं।
(ख) अयस्क – वैसे खनिज जिनसे धातु का व्यावसायिक उत्पादन होता है, अयस्क कहलाते हैं। अयस्कों में धातु प्रचुर मात्रा में उपस्थित होते हैं। इससे धात का उत्पादन सरलता से कम खर्च में होता है।
(ग) गैंग – पृथ्वी से प्राप्त खनिज अयस्कों में मिट्टी, रेत आदि कई अशुद्धियाँ होती हैं। धातुओं के निष्कर्षण से पहले अयस्क से अशुद्धियों को हटाना आवश्यक होता है। ये अशुद्धियाँ गैंग कहे जाते हैं। अयस्कों को गैंग से हटाने के लिए जिन प्रक्रियाओं का उपयोग होता है वे अयस्क एवं गैंग के भौतिक अथवा रासायनिक गुण धर्मों पर आधारित होते हैं। इनके पृथक्करण के लिए विभिन्न तकनीकों का उपयोग किया जाता है।
8.(a) रासायनिक गुणधर्मों के आधार पर धातुओं एवं अधातुओं में विभेद कीजिए।
(b) दिये गये धातुओं की क्रियाशीलता को अवरोही क्रम से व्यवस्थित करें।
(i) Zn (ii) Fe (iii) Ca (iv) Mg (v) K (vi) Na
उत्तर -(a)
| धातु | अधातु |
| 1. धातु को वायु में गर्म करने परधातु के ऑक्साइड बनते हैं। 4Na+O2 → 2Na2O 4K+O2 → 2K2O | 1. अधातु को वायु में तपाने पर अधातु के ऑक्साइड बनते हैं। S + O2 → SO2 C + O2 → CO2 |
| 2. धातु के ऑक्साइड क्षारीय होते हैं तथा जल के साथ अभिक्रिया कर क्षारक बनाते हैं। Na2O + H2O → 2NaOH (क्षार) K2O +H2O → 2KOH (क्षार) | 2. अधातुओं के ऑक्साइड अम्लीय होते हैं और जल के साथ अभिक्रिया कर अम्ल बनाता है। SO2 + H2O + H2SO3 (सल्फ्यूरस अम्ल) SO3 + H2O → H2SO4 (सल्फ्यूरिक अम्ल) |
| 3. धातुएँ अम्लों से अभिक्रिया कर हाइड्रोजन विस्थापित करती है। Ca + H 2SO 4 → CaSO4 + H2 Zn + 2HCL → ZnCl2 + H2 | 3. अधातुएँ अम्लों से अभिक्रिया नहीं करती हैं । |
| 4. कुछ धातुएँ जल से अभिक्रिया कर हाइड्रोजन उत्पन्न करती है। Ca + 2H2O → Ca(OH)2 + H2 | 4. अधातुएँ जल से अभिक्रिया नहीं करती हैं। |
(b) K, Na, Ca, Mg, Zn, Fe
9. धातुओं का संक्षारण किन-किन कारणों से होता है ?
उत्तर ⇒ धातुओं का संक्षारण निम्न कारणों से होता है –
(i) खुली वायु में सिल्वर की वस्तुओं को कुछ दिनों के लिए छोड़ देने पर उसकी सतह काली हो जाती है। सिल्वर का वायु में उपस्थित सल्फर के साथ अभिक्रिया कर सिल्वर सल्फाइड की परत बनने के कारण ऐसा होता है।
(ii) कॉपर को आर्द्र वायु में छोड़ने पर भूरे-रंग की चमक धीरे-धीरे खत्म हो जाती है तथा इस पर हरे रंग की परत चढ़ जाती है। यह हरा पदार्थकॉपर कार्बोनेट है।
(iii) लंबे समय तक लोहे की वस्तुओं को आर्द्र वायु में छोड़ देने पर उसकी परत भूरे रंग की हो जाती है जिसे जंग लगना कहा जाता है। धीरे-धीरेलोहे की वस्तुएँ संक्षारित होकर बर्बाद हो जाती हैं।
10. लोहा के एक प्रमुख अयस्क का नाम एवं सूत्र लिखें। इस अयस्क का सान्द्रण कैसे होता है ?
उत्तर ⇒लोहे के प्रमुख अयस्क हेमेटाइट Fe 2O 3 है। लोहे के निष्कर्षण में वात्य भट्ठी में होने वाली अभिक्रियाएँ –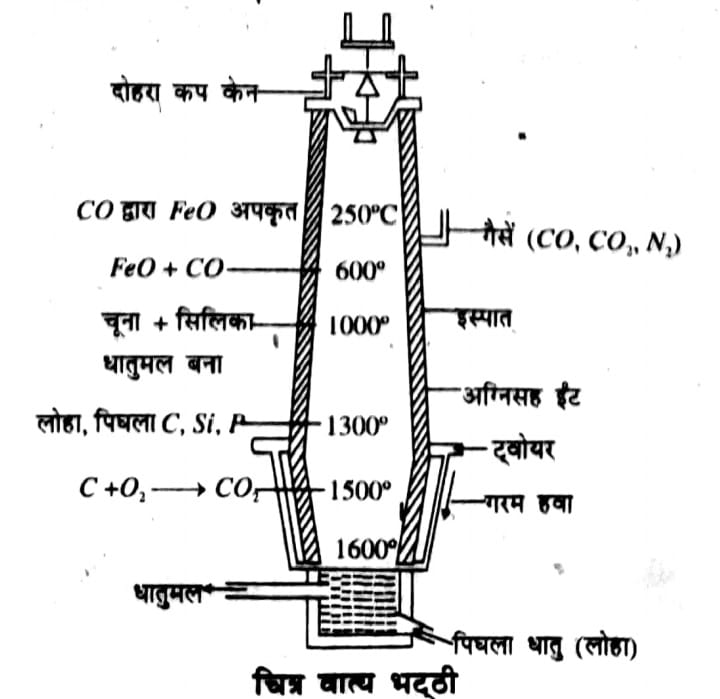
वात्य भट्ठी में चार्ज के रूप में निस्तापित अयस्क (8 भाग), कोक (4 भाग) तथा चूने का पत्थर (1भाग) का मिश्रण डाला जाता है। भट्ठी में चार्ज अधिक ताप की ओर आता जाता है और उसमें क्रमिक रूप से रासायनिक परिवर्तन होते जाते हैं। बिलकुल ऊपर शीर्ष का क्षेत्र तप्तीकरण क्षेत्र (Preliminary heating zone) कहलाता है, इसमें चार्ज की नमी आदि दूर हो जाती है।इसके बाद का क्षेत्र अपचयन का ऊपरी क्षेत्र (Upper Zone of reduction) कहलाता है जिसका ताप 900°C लगभग होता है। यहाँ निम्न अभिक्रियाएँ सम्पन्न होती हैं और CO के द्वारा फेरिक ऑक्साइड का आयरन में अपचयन हो जाता है।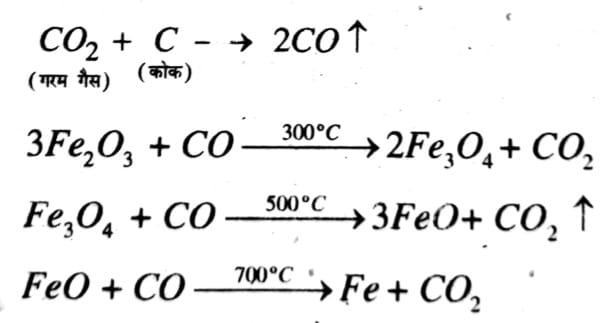 इस प्रकार Fe की प्राप्ति होती है।
इस प्रकार Fe की प्राप्ति होती है।
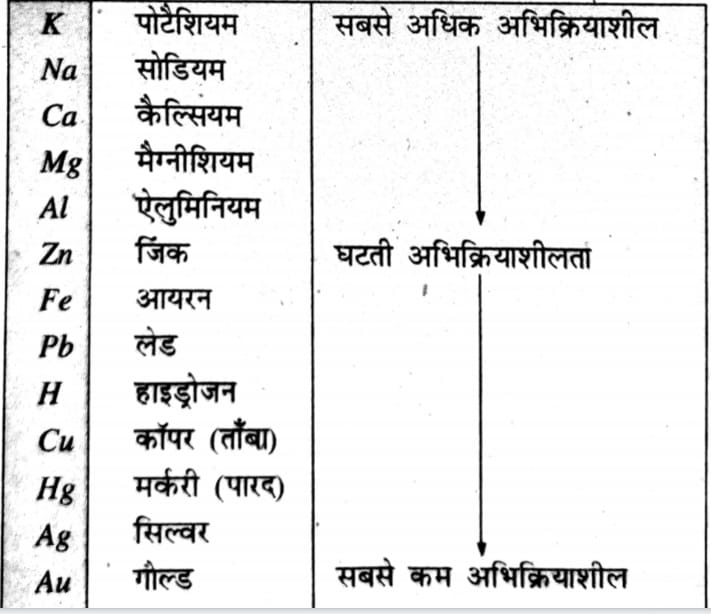
11. सक्रियता श्रेणी क्या है ?
उत्तर ⇒ सक्रियता श्रेणी वह सूची है जिसमें धातुओं की क्रियाशीलता को अवरोही क्रम में व्यवस्थित किया जाता है। इसे सक्रियता श्रेणी कहा जाता है।
नीचे धातुओं की सापेक्ष अभिक्रियाशीलताएँ दर्शायी गई हैं-
12. विद्युत अपघटनी परिष्करण द्वारा शुद्ध ताँबा की प्राप्ति कैसे की जाती है ?
उत्तर ⇒ कॉपर, जिंक, टिन, निकेल, सिल्वर, गोल्ड आदि धातुओं का परिष्करण विद्युत अपघटन द्वारा किया जाता है। __एक विद्युत् अपघटनी टैंक लिया जाता है। इसके अंदर अम्लीयकृत कॉपर सल्फेट का विलयन अपघट्य के रूप में टैंक में रखा जाता है। इस प्रक्रम में अशुद्ध ताँबे का एनोड और शुद्ध ताँबे का पतला. कैथोड बनाकर लवण विलयन में डाल दिया जाता है। विद्युत अपघट्य से जब विद्युत-धारा प्रवाहित किया जाता है, तब एनोड पर स्थित अशुद्ध धातु विद्युत अपघट्य में घुल जाती है। इतनी ही मात्रा में शुद्ध धातु विद्युत अपघट्य से कैथोड पर निक्षेपित हो जाती है। विलेय अशुद्धियाँ विलयन में चली जाती हैं तथा अविलेय अशुद्धियाँ एनोड तली पर निक्षेपित हो जाती हैं। इन अशुद्धियों को एनोड पंक कहा जाता है। इस प्रकार विद्युत अपघटन द्वारा शुद्ध धातु का परिष्करण हो जाता है।
13. जस्ता के अयस्क से जस्ता निष्कर्षण करने के सिद्धांत का उल्लेख करें।
उत्तर ⇒ आयरन, जिंक, लेड, कॉपर आदि सक्रियता श्रेणी के मध्य में पाए जाने वाले धातु हैं। प्रकृति में यह प्रायः सल्फाइड या कार्बोनेट के रूप में पायी जाती है। सल्फाइड या कार्बोनेट की तुलना में धातु को उसके ऑक्साइड के रूप में प्राप्त करना आसान है। अतः अपचयन से पहले धातु के सल्फाइड एवं कार्बोनेट को धातु के ऑक्साइड में परिणत करना जरूरी है। सल्फाइड अयस्क को वायु की उपस्थिति में अधिक ताप पर गर्म करने पर यह ऑक्साइड में बदल जाता है। इस प्रक्रिया को भंजन कहते हैं। कार्बोनेट अयस्क को सीमित वायु में अधिक ताप पर गर्म करने पर यह ऑक्साइड में बदल जाता है। इस प्रक्रिया को निस्तापन कहा जाता है। जिंक के अयस्कों के भंजन एवं निस्तापन के समय निम्नांकित अभिक्रियाएँ होती हैं –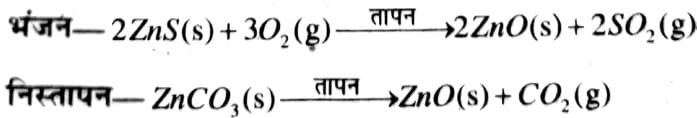
इसके बाद इन ऑक्साइडों को कार्बन द्वारा अपचयित कर धातु की प्राप्ति कर ली जाती है।
![]()
इस प्रकार धातु का निष्कर्षण हो जाता है।
14. बॉक्साइट अयस्क से एलुमिनियम धातु के निष्कर्षण संक्षेप में अभिक्रिया सफेत लिखें।
उत्तर ⇒पहले बॉक्साइट से एलुमिना का निर्माण किया जाता है। बॉक्साइट के महीन चूर्ण को गर्म सोडियम हाइड्रोक्साइड के साथ अभिक्रिया कराई जाती है। एलुमिनियम ऑक्साइड सोडियम एलुमिनेट बनकर घुल जाता है।
AI2O3 + 2H2O + 2NaOH → 2NaAIO2 + 3H2O
फिर घोल को छानकर तनु बना लिया जाता है। फिर इसमें ताजा अवक्षेपित एलुमिनियम हाइड्रॉक्साइड डालते हैं। सोडियम हाइड्रोक्साइड अवक्षेपित हो जाता है। अवक्षेप को छानकर सुखा लिया जाता है। इसे गर्म कर शुद्ध एलुमिना तैयार कर लिया जाता है।
2AI (OH)2 → AL 2O3 + 3H2O
अब एलुमिना में क्रायोलाइट मिलाकर विद्युत विच्छेदन किया जाता है। कैथोड पर एलुमिनियम और एनोड पर ऑक्सीजन मुक्त होता है।
Al2O3 → 2Al3+ + 3O2
2Al3 + 6e → 2AI (कैथोड पर)
30 2- → 3O2 + 6e (एनोड पर)
एलुमिनियम निष्कर्षण की यह बेयर विधि कहलाती है।
15. सक्रियता श्रेणी में सबसे ऊपर स्थित धातुओं का निष्कर्षण किस प्रकार किया जाता है ?
उत्तर ⇒ अभिक्रियाशीलता श्रेणी में सबसे ऊपर स्थित धातुएँ अत्यंत अभिक्रियाशील होती हैं। इन्हें कार्बन के साथ गर्म कर उनके यौगिकों से प्राप्त नहीं किया जा सकता है। कार्बन के द्वारा सोडियम, मैग्नीशियम, कैल्सियम, एलुमिनियम आदि के ऑक्साइड को अपचयन कर उन्हें धातुओं में परिवर्तित नहीं किया जा सकता है। इन धातुओं की बंधुता कार्बन की अपेक्षा ऑक्सीजन के प्रति अधिक होती है। इन धातुओं को विद्युत अपघटनी अपचयन द्वारा प्राप्त किया जा सकता है। सोडियम, मैग्नीशियम एवं कैल्सियम को उनके गलित क्लोराइडों के विद्युत अपघटन से प्राप्त किया जाता है। कैथोड पर धातुएँ निक्षेपित हो जाती हैं तथा एनोड पर क्लोरीन मुक्त होती है।
कैथोड पर – Na+ + e– → Na
एनोड पर – 2Cl– → Cl2 +2e–
इसी प्रकार एलुमिनियम ऑक्साइड के विद्युत अपघटनी अपचयन से ऐलुमिनियम प्राप्त किया जाता है।
16. सक्रियता श्रेणी में नीचे आने वाली धातुओं का निष्कर्षण कैसे किया जाता है ?
उत्तर ⇒सक्रियता श्रेणी में नीचे आने वाली धातुएँ काफी अनभिक्रियाशील होती हैं। इन धातुओं के ऑक्साइड को केवल गर्म करने से ही धातु प्राप्त किया जा सकता है। जैसे—सिनाबार (HgS) मरकरी का एक अयस्क है। वायु में गर्म करने पर यह सबसे पहले मयूंरिक ऑक्साइड (HgO) में परिवर्तित होता है और अधिक गर्म करने पर मयूंरिक ऑक्साइड मरकरी (पारद) में अपचयित हो जाता है।
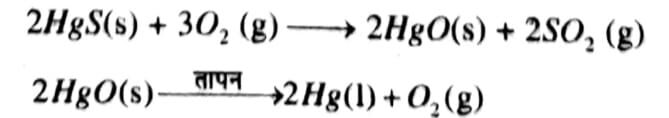
इसी प्रकार, प्राकृतिक रूप से Cu 2S के रूप में उपलब्ध ताँबे को केवल वायु में गर्म कर इसको अयस्क से अलग किया जा सकता है।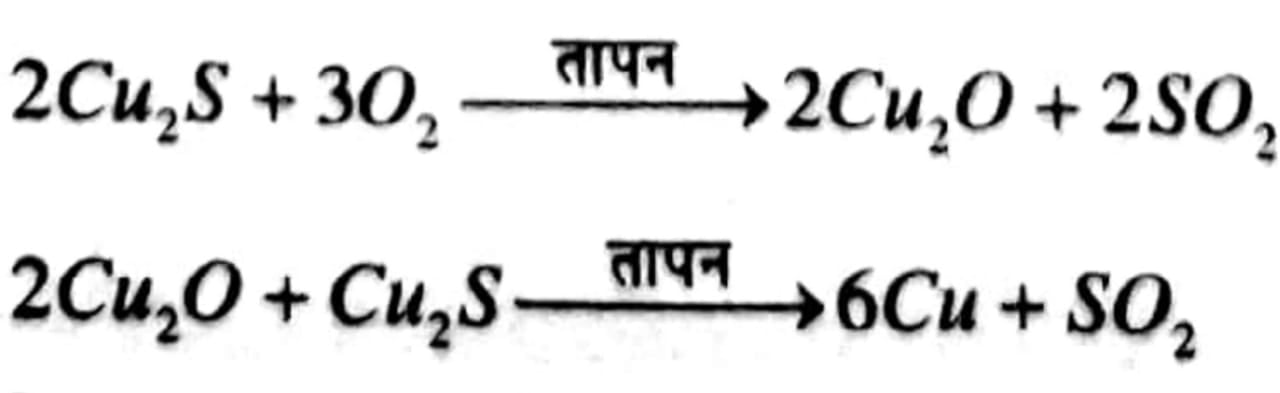
17. निस्तापन क्या है ? उदाहरण के साथ समझाइए।
उत्तर ⇒अयस्क को उसके द्रवणांक से कम तापक्रम पर तीव्रता से गर्म करने कि क्रिया जिससे उड़नशील अशुद्धियाँ बाहर निकल जाती हैं और ऑक्सीलवणऑक्साइड में परिणत हो जाता है, निस्तापन कहा जाता है।कार्बोनेट अयस्क जैसे चूना पत्थर (CACO3) के निस्तापन से कैल्सियम ऑक्साइड प्राप्त होता है। साथ ही CO2 गैस भी निकलता है।![]() इसी प्रकार जिंक कार्बोनेट के निस्तापन से ZnO और Co2 बनता है।
इसी प्रकार जिंक कार्बोनेट के निस्तापन से ZnO और Co2 बनता है।
![]()
इसके बाद कार्बन जैसे उपयुक्त अपचायक का उपयोग कर धातु ऑक्साइड से धातु प्राप्त किया जाता है। 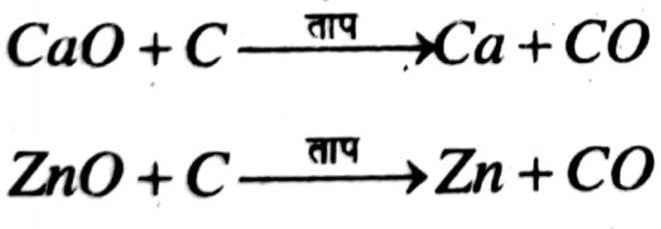
18. धातुओं एवं अधातुओं के बीच कैसे विभेद करेंगे ?
उत्तर ⇒धातुओं और अधातुओं के गुणों में विभेद-
भौतिक गुणों में विभेद धातुएँ
| धातुएँ | अधातुएँ |
| (1) धातुएँ सामान्य ताप पर ठोस होती हैं परन्तु केवल पारा सामान्य ताप पर तरल अवस्था में होता है। | (1) अधातुएँ सामान्य ताप पर तीनों अवस्थाओं में पाई जाती हैं।। फॉस्फोरस और सल्फर ठोस रूप में, H2, O2, N2 गैसीय रूप में तथा ब्रोमीन तरल रूप में होते हैं। |
| (2) धातुएँ तन्य तथा आधातवर्ध्य तथा लगिष्णु होती हैं। | (2) ये प्रायः भंगुर होती हैं। |
| (3) धातुएँ प्रायः चमकदार होती हैं अर्थात् उनमें धात्विक चमक होती हैं। | (3) अधातुओं में धात्विक चमक नहीं होती परंतु हीरा, ग्रेफाइट तथा आयोडीन इसके अपवाद हैं। |
| (4) धातुएँ ऊष्मा तथा विधुत की सुचालक होती हैं परंतु बिस्मथ इसका अपवाद है। | (4) ग्रेफाइट और गैस कार्बन को छोड़कर सभी अधातुएँ कुचालक हैं। |
| (5) धातुओं के गलनांक तथा क्वथनांक बहुत अधिक होते हैं। | (5) अधातुओं के गलनांक तथा क्वथनांक कम होते हैं। |
| (6) धातुएँ अधिकांशतः कठोर होती हैं परंतु सोडियम तथा पोटैशियम चाकू से काटी जा सकती है। | (6) इनकी कठोरता भिन्न-भिन्न होती है। हीरा सब पदार्थों से कठोरतम है। |
| (7) धातुओं का आपेक्षिक घनत्व अधिक होता है परंतु Na, K इसके अपवाद हैं। | (7) अधातुओं का आपेक्षिक ताप प्रायः कम होता है। |
| (8) धातुएँ अपारदर्शक होती हैं। | (8) गैसीय अधातुएँ पारदर्शक हैं। |
रासायनिक गुणों में विभेद
| धातुएँ | अधातुएँ |
| (1) धातुएँ क्षारीय ऑक्साइड बनाती हैं जिसमें से कुछ क्षार बनाती हैं। | (1) अधातुएँ अम्लीय तथा उदासीन ऑक्साइड बनाती हैं। |
| (2) धातुएँ अम्लों से अभिक्रिया करके हाइड्रोजन गैस पुनः स्थापित करती गैस को पुनः स्थापित नहीं करती हैं। | (2) अधातुएँ अम्लों में से हाइड्रोजन हैं तथा अनुरूप लवण बनाती हैं। |
| (3) धातुएँ धनात्मक आवेश की प्रकृति की होती हैं। | (3) अधातुएँ ऋणात्मक आवेश की प्रकृति की होती हैं। |
| (4) धातुएँ क्लोरीन से संयोग करके क्लोराइड बनाती हैं जो वैद्युत् संयोजक होते हैं। | (4) अधातुएँ क्लोरीन से संयोग कर क्लोराइड बनाती हैं, परन्तु वे सहसंयोजक होते हैं। |
| (5) कुछ धातुएँ हाइड्रोजन से संयोग करके हाइड्रोक्साइड बनाती हैं जो विधुत संयोजक होते हैं। | (5) अधातुएँ हाइड्रोजन के साथ अनेक स्थाई हाइड्राइड बनाती हैं जो सहसंयोजक होते हैं। |
| (6) धातुएँ अपचायक हैं। | (6) अधातुएँ ऑक्सीकारक हैं। |
| (7) धातुएँ जल विलयन में धनायन बनाती हैं। | (7) अधातुएँ जलीय विलयन में ऋणायन बनाती हैं। |
19. अयस्क क्या है ? अयस्क सांद्रण की सामान्य विधियों का परिचय दीजिए।
उत्तर ⇒ अयस्क – वैसे खनिज जिनसे कम खर्च में धातु का निष्कर्षण किया जाय उसे अयस्क कहते हैं।
अयस्क सांद्रण की सामान्य विधियाँ – अयस्क या खनिज पृथ्वी से निकाले जाते हैं जिनके साथ अनेक प्रकार के व्यर्थ पदार्थ होते हैं जिन्हें गैंग कहते हैं। निष्कर्षण की प्रक्रिया से पहले उन्हें हटाना आवश्यक होता है। इस प्रकार गैंग का साथ हटाने से अयस्क में धातु की मात्रा, अधिक हो जाती है जिसे सांद्रण कहते हैं।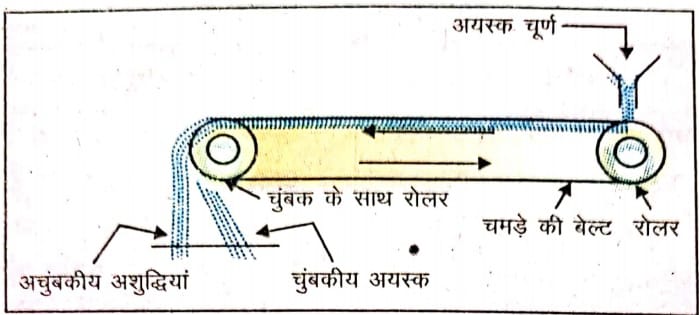
अतः किसी अयस्क को अगले प्रक्रमों के लिए तैयार करने के लिए अयस्क का सांद्रण करना होता है । अयस्क से गैंग हटाने की विधि अयस्क के तथा गैंग के भीतर या रासायनिक गुणों के अंतर पर आधारित होती है।
सांद्रण की भौतिक विधियाँ –
(i)चंबकीय विधि – यह विधि आयरन, कोबाल्ट, निकिल ; जैसे-चुंबकीय पदार्थों की अशुद्धियों को अलग करने के लिए स्वीकार की जाती है। जो खनिज चुंबकीय प्रकृति के होते हैं वे चुंबकीय क्षेत्र की ओर आकर्षित होते हैं जबकि गैंग आदि आकर्षित नहीं होते । क्रोमाइट तथा पाइरोल्युसाइट के अयस्क इसी विधि द्वारा सांद्रित किए जाते हैं। इस विधि में पीसे हुए अयस्क को एक कन्वेयर बैल्ट के ऊपर रखते हैं। कन्वेयर बैल्ट दो रोलरों के ऊपर से गुजरती है जिनमें से एक चुंबकीय होता है। जब अयस्क चुंबकीय किनारे पर से नीचे आता है, तो चुंबकीय और अचुंबकीय पदार्थ दो अलग-अलग ढेरों में एकत्रित हो जाते हैं। लोहे के अयस्क मैग्नेटाइट का सांद्रण इसी विधि द्वारा किया जाता है।
(ii)द्रवचालित धोना – इस विधि में बारीक पिसे हुए अयस्क को पानी की तेज धार में धोया जाता है। इस तेज धार में हल्के गैंग कण बह जाते हैं जबकि भारी खनिज कण तली में बैठ जाते हैं। टिन और लैड के अयस्क इसी विधि द्वारा सांद्रित किए जाते हैं।
(iii)फेन-प्लावन विधि – इस विधि में बारीक पिसे हुए अयस्क को जल एवं किसी उपयुक्त तेल के साथ एक बड़े टैंक में मिलाया जाता है। खनिज कण पहले ही तेल से भीग जाते हैं जबकि गैंग के कण पानी से भीग जाते हैं। अब इस मिश्रण में से बुलबुलों के रूप में वायु प्रवाहित की जाती है जिससे खनिज कण युक्त तेल के झाग या फेन बन जाते हैं जो जल की सतह पर तैरने लगती है जिन्हें बड़ी सरलता से जल के ऊपर से निकाला जा सकता है। ताँबा, सीसा तथा जिंक के सल्फाइड का सांद्रण करने के लिए इस विधि का प्रयोग किया जाता है।
(iv) रासायनिक विधियाँ – रासायनिक पृथक्करण में खनिज तथा गैंग के मध्य रासायनिक गुणों के अंतर का उपयोग किया जाता है। इसकी एक मुख्य विधि है—बेयर की विधि, जिसके द्वारा बॉक्साइट से ऐलुमिनियम ऑक्साइड प्राप्त किया जाता है।
बेयर विधि द्वारा ऐलुमिनियम अयस्क का सांद्रण -:
इस विधि में बॉक्साइट को गर्म साडियम हाइड्रोक्साइड के साथ अपचयित किया जाता है जिसे NaAlO2 जो जल में घलनशील हैं, गैंग को छानकर अलग कर दिया जाता है। NaAlO2 का हाइडोक्लोरिक अम्ल से अभिक्रिया करवाई जाती है जिससे ऐलुमिनियम हाइड्रोक्साइड प्राप्त होता है । जिसके बाद ऐलुमिनियम हाइड्रोक्साइड को गर्म करके शुद्ध एलुमिनियम ऑक्साइड प्राप्त होता है। विभिन्न अभिक्रियाएँ निम्नलिखित प्रकार से है –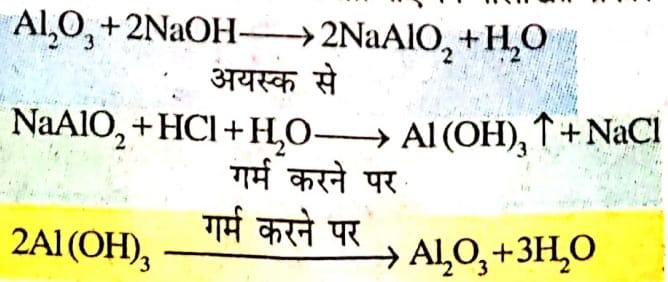
20. मिश्रधातु किस कहते हैं ? इनके बनाने के उद्देश्यों का वर्णन करें।
उत्तर ⇒मिश्रधातु किसी धात का किसी अन्य धातु या अधातु के साथ मिलाकर बनाया गया संगामी मिश्रण, मिश्रधातु कहलाता है। जैसे—टांके में कलई तथा सीसा समान मात्रा में मिलाया जाता है। उदाहरण के लिए, स्टेनलेस स्टील, टांका, पीतल, कांसा बैलमैटल आदि सभी मिश्रधातुएँ हैं।
मिश्रधातुआ क उपयोग
(i) कठोरता बढ़ाने के लिए – लोहे में कार्बन की मात्रा मिलाकर स्टेनलैस स्टील बनाया जाता है जो लोहे से अधिक कठोर होता है । सोने में तांबा तथा चांदी में सीसा मिलाने से उनकी कठोरता अधिक हो जाती है। ड्यूरेलियम ऐलमिनियम से बना मिश्र धातु है जो अत्यधिक कठोर होता है।
(ii) शक्ति बढ़ाने के लिए – इस्पात, ड्यूरेलियम आदि मिश्र धातु कठोर होने के कारण शक्तिशाली भी होते हैं।
(ii) संक्षारण रोकने के लिए – जैसे स्टेनलेस स्टील, लोहे तथा जिंक से बनी मिश्र धातु आदि पर जंग नहीं लगता ।
(iv) ध्वनि उत्पन्न करने के लिए – ताँबे तथा कलई से बनाई गई मिश्र धात बैल मैटल होती है जिससे अधिक ध्वनि उत्पन्न हो जाती है।
(v) गलनांक कम करने के लिए – जैसे रोज-मैटल मिश्र धात है। इसका गलनांक कम होता है। यह बिस्मथ कलूई और सीसे बनती है।
(vi) उचित साँचे में ढालने के लिए – काँसा तथा टाइप मैटल ।
(vii) रंग परिवर्तन के लिए – ताँबे तथा ऐलुमिनियम से बनी ऐलमिनियम ब्रांज मिश्र धातु का सुनहरी रंग होता है।
(vii) घरेलू उपयोग – घरों, कारखानों, दफ्तरों में सभी जगह मिश्र धातुओं का उपयोग होता है जैसे घर के बर्तन, अलमारी, पंखे, फ्रिज, आभूषणों आदि में मिश्र धातुओं का उपयोग होता है।
21. जारण और निस्तापन से आप क्या समझते हैं ? एक उदाहरण देकर समझायें । अभिक्रिया श्रेणी (Reactivity Series) के मध्य के तत्वों का निष्कर्षण उनके oxides से किस प्रकार करते हैं ?
उत्तर ⇒ जारण या भर्जन (Roasting) भर्जन में सान्द्रित अयस्क को वायु की अधिकता में खुब गर्म किया जाता है जिससे वाष्पशील अशद्धियाँ बाहर निकल जाती हैं तथा अयस्क का ऑक्सीकरण हो जाता है। यह मुख्य रूप से सल्फाइड अयस्कों के लिए परावर्तनी भट्टी में किया जाता है। जैसे जिंक ब्लैण्ड (ZnS) का जारण 2ZnS + 3O2 2ZnO + 2sO2
निस्तापन (Calcination) – सान्द्रित अयस्क को वायु की अनुपस्थिति में उसके गलनांक से नीचे गर्म करने पर उसमें से वाष्पशील अशुद्धियाँ अलग हो जाती हैं तथा अयस्क सरन्ध्र (Porous) हो जाता है । यह मुख्य रूप से कार्बोनेट, हाइड्रेटेड अयस्कों में किया जाता है।![]()
अभिक्रिया श्रेणी के मध्य के तत्वों का निष्कर्षण उनके ऑक्साइड को कार्बन द्वारा अपचयन से करते हैं।
ZnO + C → Zn + CO
Fe2O3 + 3C → 2Fe +3CO
22. बॉक्साइट का रासायनिक सूत्र लिखें। एल्यमीनियम का शोधन कैसे किया जाता है ?
उत्तर ⇒बॉक्साइट का रासायनिक सूत्र : एल्युमीनियम का शोधन वैद्युत अपघटन विधि द्वारा होता है। इसमें अशुद्ध एल्युमीनियम को एनोड एवं शुद्ध एल्युमीनियम की प्लेट को कैथोड के रूप में इस्तेमाल किया जाता है। एल्युमीनियम के एक लवण का विलयन वैद्युत अपघट्य का कार्य करता है। विद्युत धारा प्रवाहित करने पर एनोड से शुद्ध धातु निकलकर विलयन में जाती है और विलयन में से उतनी ही शुद्ध धातु कैथोड पर एकत्रित हो जाती है। विलेय अपद्रव्य विलयन में चले जाते हैं, जबकि अविलेय ऐनोड के नीचे पेंदी में एकत्र हो जाते हैं जो ‘एनोड मड’ कहलाते हैं।
23. (a) लोहा के एक प्रमुख अयस्क का नाम एवं इसका सूत्र लिखें। (b) इस अयस्क का सांद्रण कैसे होता है ?
उत्तर ⇒ (a) हेमेटाइट – Fe2O3 . xH2O ; मैग्नेटाइट – Fe3O4
(b) लोहा के अयस्क का सान्द्रण : लोहा के अयस्क का सान्द्रण चुम्बकीय पृथक्करण विधि द्वारा किया जाता है। इस विधि में दो पूलियों के ऊपर का अचुम्बकीय बेल्ट चढ़ा होता है। एक पूली अचुम्बकीय होती है तथा दूसरी पूली एक विद्युत चुम्बक की बनी होती है। अचुम्बकीय पूली पर चूर्णित अयस्क गिराया जाता है जो बेल्ट के सहारे चुम्बकीय पूली तक जाता है और वहाँ चुम्बकीय अयस्क अचुम्बकीय अशुद्धियों से पृथक हो जाता है।
class 10 science question answer
| S.N | Physics ( भौतिक विज्ञान ) दीर्घ उत्तरीय प्रश्न |
| 1 | प्रकाश के परावर्तन तथा अपवर्तन |
| 2 | मानव नेत्र तथा रंगबिरंगा संसार |
| 3 | विधुत धारा |
| 4 | विधुत धारा के चुंबकीय प्रभाव |
| 5 | ऊर्जा के स्रोत |
| S.N | Chemistry ( रसायन विज्ञान ) दीर्घ उत्तरीय प्रश्न |
| 1 | रासायनिक अभिक्रियाएं एवं समीकरण |
| 2 | अम्ल क्षार एवं लवण |
| 3 | धातु एवं अधातु |
| 4 | कार्बन और उसके यौगिक |
| 5 | तत्वों का वर्गीकरण |
| S.N | Biology ( जीव विज्ञान ) दीर्घ उत्तरीय प्रश्न |
| 1 | जैव प्रक्रम |
| 2 | नियंत्रण एवं समन्वय |
| 3 | जीव जनन कैसे करते हैं |
| 4 | अनुवांशिकता एवं जैव विकास |
| 5 | हमारा पर्यावरण |
| 6 | प्राकृतिक संसाधनों का प्रबंधन |
क्लास 10th विज्ञान का ऑब्जेक्टिव प्रश्न तथा सब्जेक्टिव प्रश्न और मॉडल पेपर इस वेबसाइट पर उपलब्ध है जहां से आप लोग मैट्रिक परीक्षा 2022 की तैयारी कर सकते हैं। क्लास 10th साइंस क्वेश्चन आंसर