रासायनिक समीकरण को संतुलित कैसे करें? | How to balance a Chemical Equation ? | Rasayanik Samikaran Santulit Kaise Karen
How to balance a Chemical Equation: रासायनिक समीकरण को संतुलित करने से पहले आपको रसायन विज्ञान के कुछ बेसिक जानकारी पता होना चाहिए जैसे रासायनिक अभिक्रिया क्या होता है ? प्रतिकारक अथवा अभिकारक क्या होता है रसायनिक समीकरण क्या होता है? रासायनिक अभिक्रिया को संतुलित करना क्यों आवश्यक है ? यह सब जानकारी आपको पता होना चाहिए तभी आप एक रासायनिक समीकरण को संतुलित कर पाएंगे नीचे पूरी जानकारी दिया गया है पूरी जानकारी को ध्यानपूर्वक पढ़ें।
| Also Read : class 10th science objective |
रासायनिक अभिक्रिया (Chemical Reactions)—जब तत्त्व आपस में संयोग कर यौगिक का निर्माण करते हैं अथवा यौगिक अपघटित होकर नये यौगिकों को बनाते हैं, तो रासायनिक अभिक्रियाएँ सम्पन्न होती हैं।
जैसे— हाइड्रोजन ऑक्सीजन से संयोग कर जल बनाते हैं अथवा कैल्सियम कार्बोनेट को गर्म करने पर यह अपघटित होकर कैल्सियम ऑक्साइड और कार्बन डाइऑक्साइड बनाते हैं तो ऐसी स्थिति में रासायनिक अभिक्रियाएँ सम्पन्न होती है।
अतः, इसकी परिभाषा निम्नांकित प्रकार से दी जा सकती है :
परिभाषा- जब एक पदार्थ किसी दूसरे पदार्थ से क्रिया करके अथवा कोई पदार्थ स्वयं क्रिया करके एक या एक से अधिक नये पदार्थों व रचना करता है, तो वैसी क्रिया को ये रासायनिक अभिक्रिया कहते हैं।
प्रतिकारक अथवा अभिकारक (Reactants)-रासायनिक अभिक्रिया में मुख्य रूप से भाग लेने वाले पदार्थों को अभिकारक कहते हैं।
उत्पाद (Product)-रासायनिक अभिक्रिया के बाद प्राप्त होनेवाले पदार्थों को उत्पाद अथवा प्रतिफल कहते हैं।
रासायनिक समीकरण (Chemical Equations)- जिस प्रकार प्रतीकों अथवा संकेतों से तत्त्वों के परमाणुओं और सूत्रों से अणु प्रकट किये जाते हैं, उसी प्रकार रासायनिक अभिक्रिया को रसायन की भाषा में व्यक्त करने की विधि को रासायनिक समीकरण कहते हैं।
जैसे- पोटैशियम क्लोरेट को गर्म करने पर पोटैशियम क्लोराइड तथा ऑक्सीजन गैस बनते हैं। इस अभिक्रिया को शब्दों में निम्नांकित प्रकार से व्यक्त किया जाता है :
पोटैशियम क्लोरेट → पोटैशियम क्लोराइड + ऑक्सीजन
अब इसे रसायन की भाषा में अर्थात् सूत्रों की मदद से निम्नांकित प्रकार से व्यक्त कर सकते हैं-
![]()
ऐसे रासायनिक समीकरणों को ढाँचा समीकरण (Skeleton Equation) भी कहते हैं। इनमें दोनों ओर परमाणुओं की संख्याएँ बराबर नहीं हैं, लेकिन इसे निम्नलिखित
प्रकार से लिखें :
![]()
अब दोनों ओर परमाणुओं की संख्याएँ बराबर हो जाती हैं। ऐसे समीकरण को संतुलित समीकरण (Balanced Equation) कहते हैं।
यहाँ 3O2 को अणु के रूप में व्यक्त किया गया है, इसलिए इसे आण्विक समीकरण (Molecular Equation) कहते हैं।
रासायनिक अभिक्रिया को समीकरण में लिखने के नियम :
(i) अभिकारक, जो अभिक्रिया में भाग लेते हैं, उसे तीर-चिह्न (→) की बाई ओर लिखा जाता है।
(ii) उत्पाद, जो रासायनिक अभिक्रिया के बाद बनता है, उसे तीर-चिह्न (→) की दायीं ओर लिखा जाता है।
(iii) यदि तीर-चिह्न (→) की दोनों ओर अभिकारक तथा उत्पाद एक से अधिक हों, तो उनके बीच योग (+) चिह्न का प्रयोग करते हैं।
(iv) तीर-चिह्न (→) यह निर्देशित करता है कि अभिकारक अभिक्रिया करके उत्पाद बनाता है। कभी-कभी तीर-चिह्न (→) के स्थान पर बराबर के चिह्न (=) का भी प्रयोग किया जाता है, लेकिन आजकल तीर-चिह्न (→) का ही प्रयोग होने लगा है।
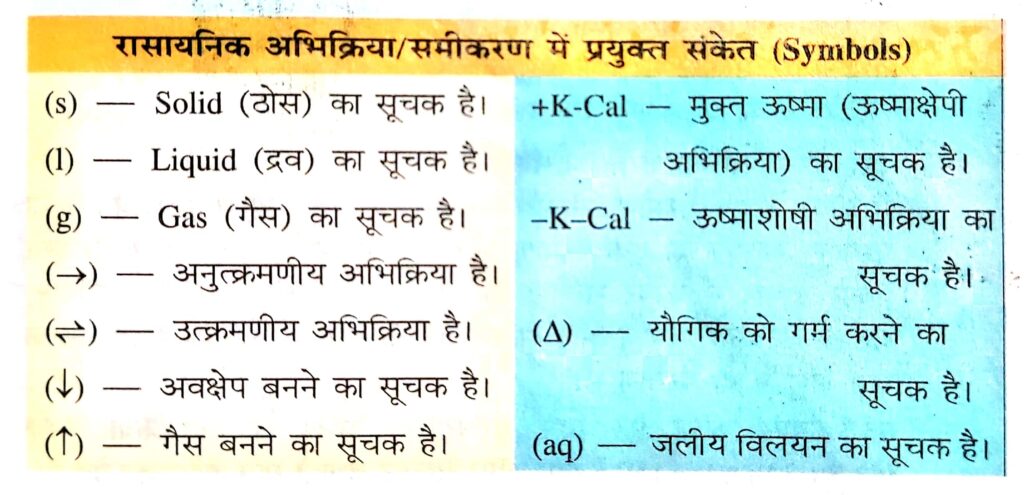
रासायनिक अभिक्रिया/समीकरण में प्रयुक्त संकेत (Symbols)
 रासायनिक समीकरण-सम्बन्धी प्रमुख बातें (Important Facts Regarding Chemical Equations) :
रासायनिक समीकरण-सम्बन्धी प्रमुख बातें (Important Facts Regarding Chemical Equations) :
रासायनिक समीकरण-सम्बन्धी प्रमुख बातें निम्नलिखित हैं :
(i) रासायनिक समीकरण किसी वास्तविक रासायनिक अभिक्रिया का सूचक होना चाहिए।
(ii) समीकरण संतुलित हो अर्थात् तीर-चिह्न (→) की दोनों ओर विभिन्न तत्त्वों के परमाणुओं की संख्याएँ समान होनी चाहिए।
(iii) अभिक्रिया से सम्बन्धित सभी अभिकारक (Reactants) तथा उत्पाद (Products) दोनों ज्ञात होने चाहिए।
(iv) यह प्रतीकों (धातुओं तथा अन्य तत्त्वों के लिए) और अणु-सूत्रों के द्वारा व्यक्त होना चाहिए अर्थात् यह अणु-सूत्रमुखी (Molecular) होना चाहिए।
जैसे-सोडियम और कैल्सियम को क्रमशः Na और Ca द्वारा तथा नाइट्रोजन और ऑक्सीजन को N2 और O2 द्वारा व्यक्त होना चाहिए न कि
N तथा O द्वारा।
रासायनिक समीकरणों का संतुलन (Balancing of Chemical Equations):
रासायनिक समीकरणों को संतुलित करने से पहले निम्नलिखित समीकरणों पर ध्यान दें :
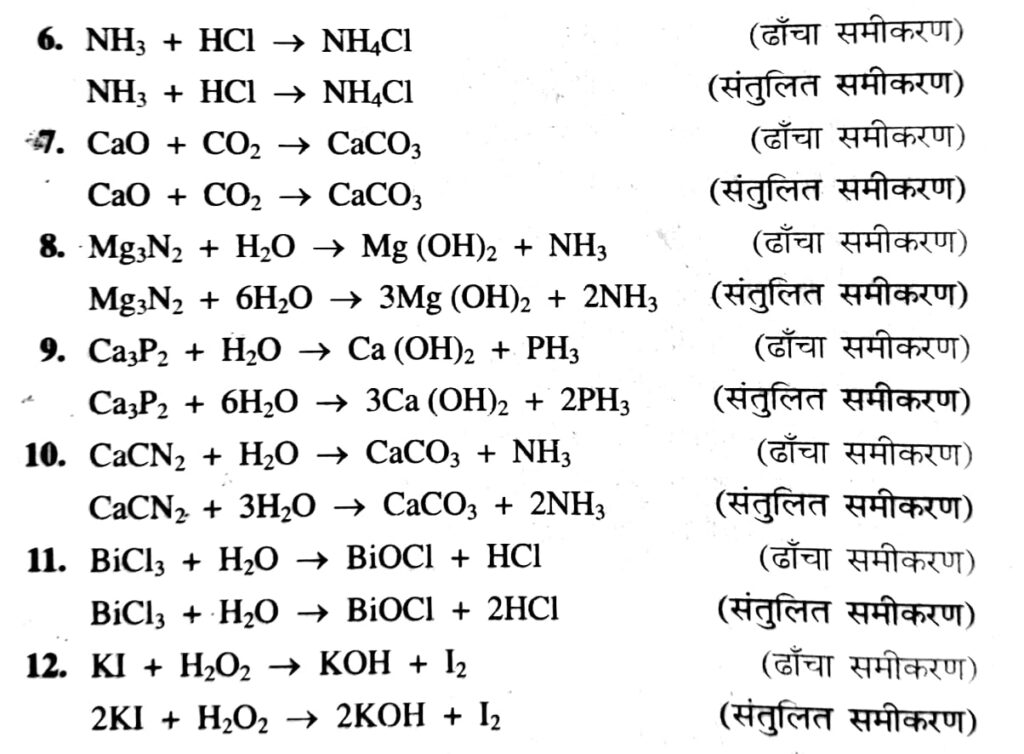
(i) H2 + O2 → H2O (ढाँचा समीकरण)
(ii) 2H2 + O2 → 2H2O (संतुलित समीकरण)
(i) में दर्शाए गए समीकरण को ढाँचा समीकरण कहते हैं, क्योंकि इसमें अभिकारक तथा उत्पाद में तत्त्व के अणुओं में परमाणुओं की संख्याएँ बराबर नहीं हैं, जबकि
(ii) में दर्शाए गए समीकरण को संतुलित समीकरण कहते हैं। इसमें दोनों ओर परमाणुओं की संख्याएँ बराबर हैं।
रासायनिक समीकरण संतुलित करने की विधि (Method)
समीकरण को संतुलित करने की विधियाँ निम्नलिखित हैं :
(1) अनुमान विधि (Hit and Trial Method)
(II) आंशिक समीकरण विधि (Partial Equations Method)|
I. संतुलन की अनुमान या अंदाज विधि (Hit and Trial Method) : इस विधि से सरल रासायनिक समीकरणों का संतुलन बड़ी सुगमता से हो जाता है। इसमें समीकरण की दोनों ओर प्रत्येक तत्त्व के परमाणुओं की संख्या बराबर करने का प्रयास किया जाता है। अब समीकरणों के संतुलन के लिए निम्नलिखित मुख्य बिंदुओं पर ध्यान देने की आवश्यकता है :
(i) सबसे पहले अभिकारकों और उत्पादों के सूत्र क्रमशः तीर-चिह्न (→) की बाईं ओर और दाईं ओर लिखे जाते हैं। इस प्रकार समीकरण का ढाँचा तैयारकर लिया जाता है।
(ii) अब समीकरण में दोनों ओर अभिकारकों तथा उत्पादों में सदृश तत्त्वों के परमाणुओं की संख्या को गिनते हैं।
(iii) इसके बाद सबसे पहले उस परमाणु का संतुलन किया जाता है, जो सबसे कम स्थानों पर आया है। अंत में वैसे परमाणुओं का संतुलन किया जाता है, जो अधिक स्थानों पर अधिक बार आये हैं। इस प्रकार दोनों ओर परमाणुओं की संख्याएँ बराबर कर समीकरणों का संतुलन किया जाता है।
नोट : रासायनिक समीकरण में यदि तात्त्विक गैसें (H,, O, या N, इत्यादि) आयी हों, तो समीकरण को संतुलित करते समय इन्हें परमाण्विक अवस्था में रखा जाता है, फिर 2 से गुणा करने पर आण्विक समीकरण (Molecular Equation) बन जाता है।
कुछ उदाहरणों की सहायता से समीकरणों को संतुलित करने का प्रयास करेंगे:
उदाहरण 1. नाइट्रोजन एवं हाइड्रोजन के संयोग से अमोनिया बनाने के लिए रासायनिक समीकरण को संतुलित करना :
नाइट्रोजन एवं हाइड्रोजन परस्पर संयोग कर अमोनिया बनाते हैं। इस अभिक्रिया के लिए :
(i) सबसे पहले ढाँचा समीकरण लिखा जाता है।
नाइट्रोजन + हाइड्रोजन → अमोनिया
N2 + H2→ NH3
(ii) अब दोनों ओर तत्त्व के अणुओं में परमाणुओं की संख्या गिनते हैं। यहा अभिकारक में नाइट्रोजन के दो परमाणु और हाइड्रोजन के दो परमाणु हैं, लेकिन उत्पाद में नाइट्रोजन के एक परमाणु तथा हाइड्रोजन के 3 परमाणु है।
(iii) यहाँ हम देखते हैं कि हाइड्रोजन परमाणुओं की संख्या दोनों ओर समान नहीं हैं, अतः इसे समान करने का प्रयत्न करेंगे।
(iv) अब हाइड्रोजन की संख्या समान करने के लिए अभिकारक (H) में 3 से तथा उत्पाद (NH3 ) में 2 से गुणा करते हैं। इस प्रकार समीकरण का रूप निम्नलिखित हो जाता है :
N2+ 3H2 → 2NH3 (संतुलित समीकरण)
अब एक बार फिर परमाणुओं की संख्या की गिनती करें, तो दोनों ओर ये .. संख्याएँ समान हो जाती हैं। अतः, यह समीकरण संतुलित समीकरण है।
उदाहरण 2. मेथेन गैस को ऑक्सीजन में जलाने पर जल और कार्बन डाइऑक्साइड गैस बनते हैं।
(i) इस अभिक्रिया का ढाँचा समीकरण होगा :
मेथेन + ऑक्सीजन → कार्बन डाइऑक्साइड + जल
CH4 + O2 → CO2 + H2O (ढाँचा समीकरण)
(ii) यह ढाँचा समीकरण संतुलित अवस्था में नहीं है, क्योंकि हाइड्रोजन और ऑक्सीजन की संख्याएँ दोनों ओर समान नहीं हैं।
(iii) अब अभिकारक के O2 में 2 से तथा उत्पाद के H2O में 2 से गुणा करें, तो समीकरण का रूप होगा :
CH4 + 2O2 → CO2 + 2H2O (संतुलित समीकरण)
(iv) अब यहाँ हाइड्रोजन, कार्बन तथा ऑक्सीजन के परमाणुओं की संख्याएँ दोनों ओर समान हैं। अतः, यह संतुलित समीकरण है।


Class 10th Science Objective Question
| S.N | Physics Objective Question |
| 1 | प्रकाश के परावर्तन तथा अपवर्तन |
| 2 | मानव नेत्र तथा रंगबिरंगा संसार |
| 3 | विधुत धारा |
| 4 | विधुत धारा के चुम्बकीय प्रभाव |
| 5 | ऊर्जा के स्रोत |
| S.N | Chemistry Objective Question |
| 1 | रासायनिक अभिक्रिया एवं समीकरण |
| 2 | अम्ल क्षार तथा लवण |
| 3 | धातु एवं अधातु |
| 4 | कार्बन और उसके यौगिक |
| 5 | तत्वों का वर्गीकरण |
| S.N | Biology Objective Question |
| 1 | जैव प्रक्रम |
| 2 | नियंत्रण एवं समन्वय |
| 3 | जीव जनन कैसे करते हैं |
| 4 | अनुवांशिकता एवं जैव विकास |
| 5 | हमारा पर्यावरण |
| 6 | प्राकृतिक संसाधनों का प्रबंधन |